一般に臨床試験は単一の疾患に対して単一の治療法を評価するように設計されます。ただこのような従来の臨床試験の設計は、対象患者が少ない希少疾患では開発の壁となることも少なくありません。
そこで近年効率的な治療開発を目的としたマスタープロトコルという考え方が広がってきています!
この記事ではマスタープロトコルの考え方と提案されているデザインを解説します!
マスタープロトコルで行われた臨床試験の実例もありますのでぜひ参考にしてみてください!
マスタープロトコルとは?

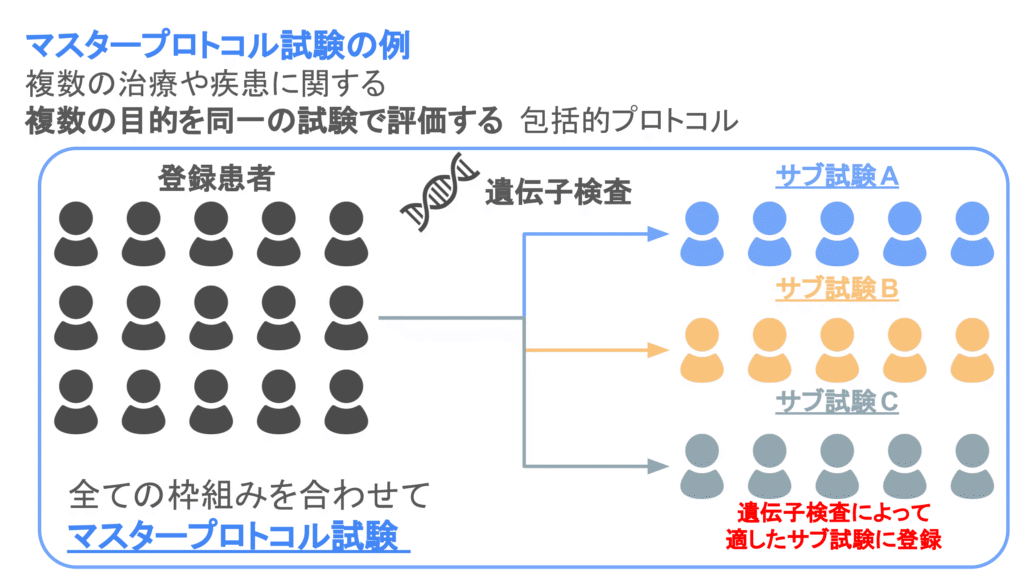
マスタープロトコルとは、複数の治療や疾患に関する複数の目的を同一の試験で評価する包括的プロトコルのことです。
マスタープロトコルの傘下には複数のサブ試験が立てられ、サブ試験ごとまたはサブ試験を併合して治療法の有効性や安全性が評価されます。
サブ試験の例として、同一薬剤の有効性を複数のがん種で評価したり、単一疾患に対して複数の薬剤の有効性を評価することが考えられます。
マスタープロトコルの構成
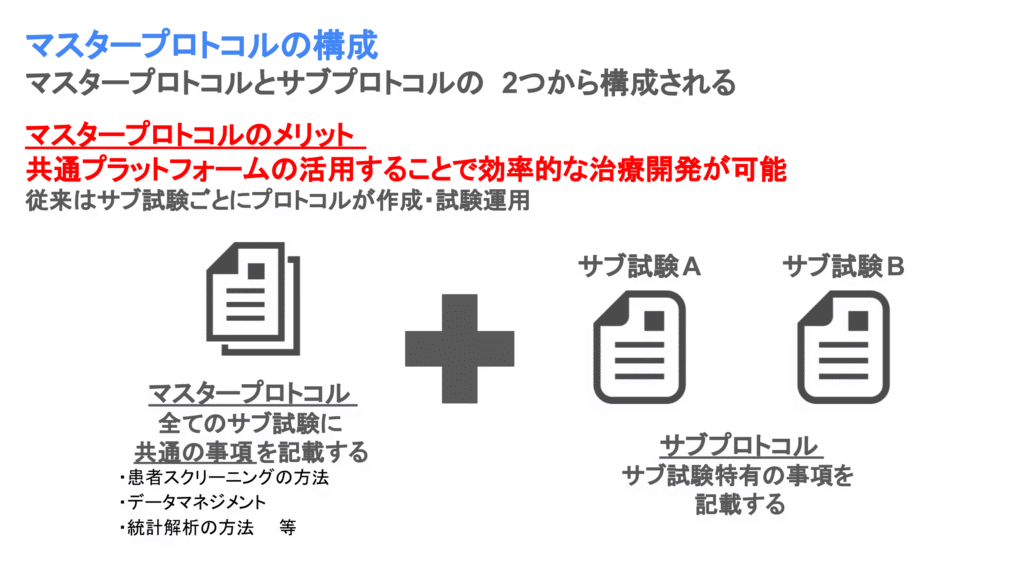
マスタープロトコル下で行われる臨床試験では、マスタープロトコルとサブプロトコルの2種類が作成されます。サブ試験間で共通項目をマスタープロトコル、サブ試験特有の事項をサブプロトコルに記載します。
それにより、マスタープロトコルに記載されるような同一の手続きやプラットフォームを利用して試験を実施できるため、単一の試験を複数立てるよりも効率的に試験が実施できるようになります。
マスタープロトコルに記載される共通事項には以下のようなものがあります。
マスタープロトコルに記載される共通事項の例
- 患者スクリーニングの検査方法
- 共通のCRFを用いたデータマネジメント
- エンドポイントの定義や統計解析の方法
主に抗がん剤の開発において発展してきましたが、近年ではCOVID-19の治療法開発にも貢献しました。ただ今回は抗がん剤開発に使用されているマスタープロトコル試験を中心に解説します!
マスタープロトコルの試験デザインと実例

マスタープロトコルの試験デザインには大きく分けて3つの試験デザインがあります。
マスタープロトコルの試験デザイン
- アンブレラ試験
- バスケット試験
- プラットフォーム試験
以下では各試験デザインの概要と実際の試験デザインを紹介します!
| 試験デザイン | 特徴 | 臨床研究の実例 |
|---|---|---|
| アンブレラ試験 | 単一の疾患に対して複数の薬剤の有効性を検証する試験 | ALCHEMIST試験 (非小細胞肺がん) |
| バスケット試験 | 複数の疾患に対して単一の薬剤の有効性を検証する試験 | BRAF V600試験 (ベムラフェニブ) |
| プラットフォーム試験 | 半永続的に単一または複数の疾患に対して複数の治療の有効性を検証する試験 | I-SPY2 (乳がん) |
アンブレラ試験
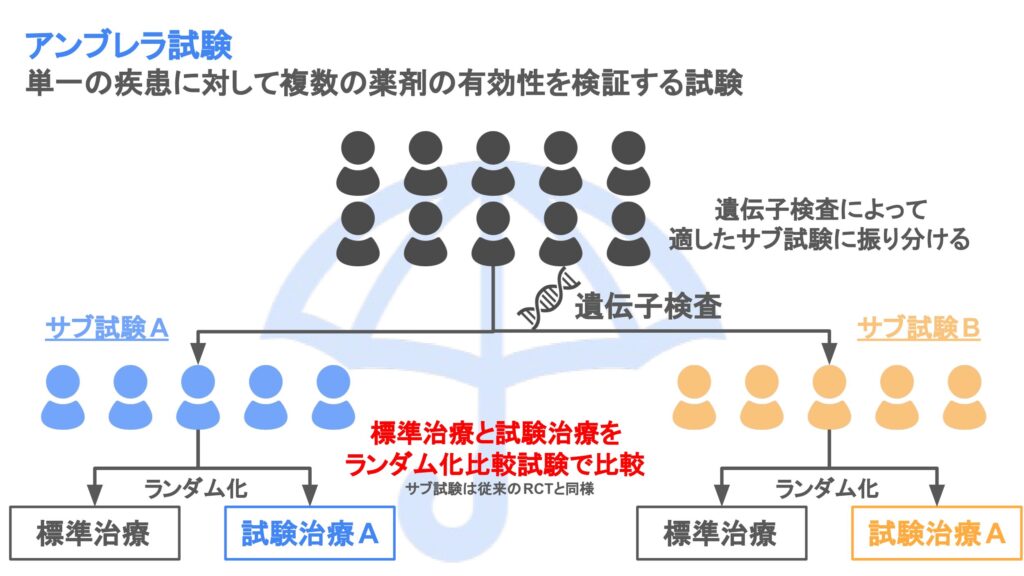
アンブレラ試験は単一の疾患に対して複数の薬剤の有効性を検証する試験デザインです。主にPhase III試験として行われます。
名前のイメージとしては、「登録される患者」を雨として、「遺伝子検査」という傘(アンブレラ)によって、患者がより分けられていく感じです。
アンブレラ試験の特徴は一般にサブ試験が検証的なランダム化比較試験となっている点です。つまり、従来の試験デザインを踏襲しながら、共通のプラットフォームを用いることで効率的な開発が行えるという利点があります。
アンブレラ試験の例:ALCHEMIST試験
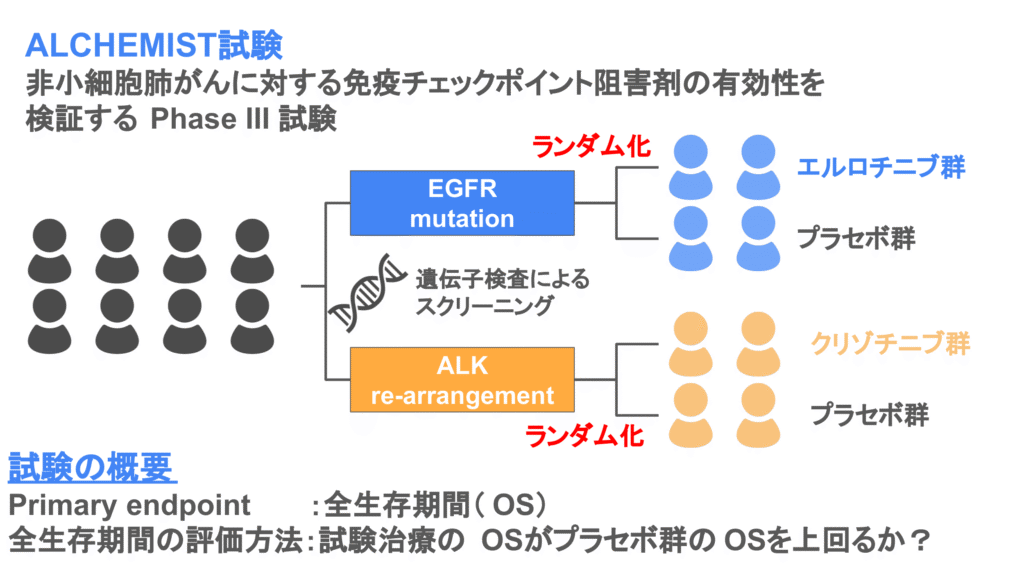
アンブレラ試験の例として、非小細胞がん患者を対象としたALCHEMIST試験があります。
https://ascpt.onlinelibrary.wiley.com/doi/10.1002/cpt.91
ALCHEMIST試験は非小細胞肺がん患者を遺伝子検査によってスクリーニングし、異常遺伝子に対応する免疫チェックポイント阻害薬の有効性を評価します。対象となっているのは非小細胞肺がんの中でも、EGFR mutationまたはALK re-arrangementを有する非小細胞肺がん患者です。
EGFR mutationを有する非小細胞肺がん患者はエルロチニブの有効性を、ALK re-arrangementを有する非小細胞肺がん患者はクリゾチニブの有効性をプラセボと比較して評価します。
バスケット試験
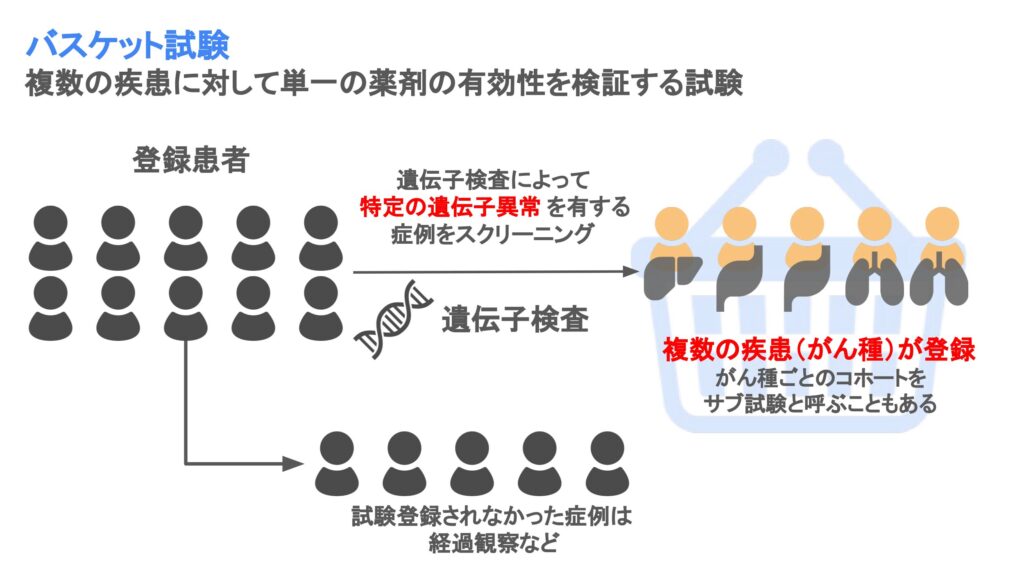
バスケット試験は複数の疾患に対して単一の薬剤の有効性を検証する試験デザインです。主にPhase II試験として行われます。
バスケット試験のイメージとしては、「複数の疾患」をフルーツとして、かご(バスケット)というサブ試験により分けていくイメージです。
バスケット試験による有効性は疾患(がん種)ごと、または疾患を併合して評価されます。
例えば、同一の遺伝子異常を有するがん種のであれば、その遺伝子異常をターゲットとした治療はがん種に関係なく有効である、という前提が考えられます。このような場合には併合して評価することで、解析対象の症例数が増え、検出力が上昇する、というメリットがあります。
バスケット試験の例:BRAF V600試験
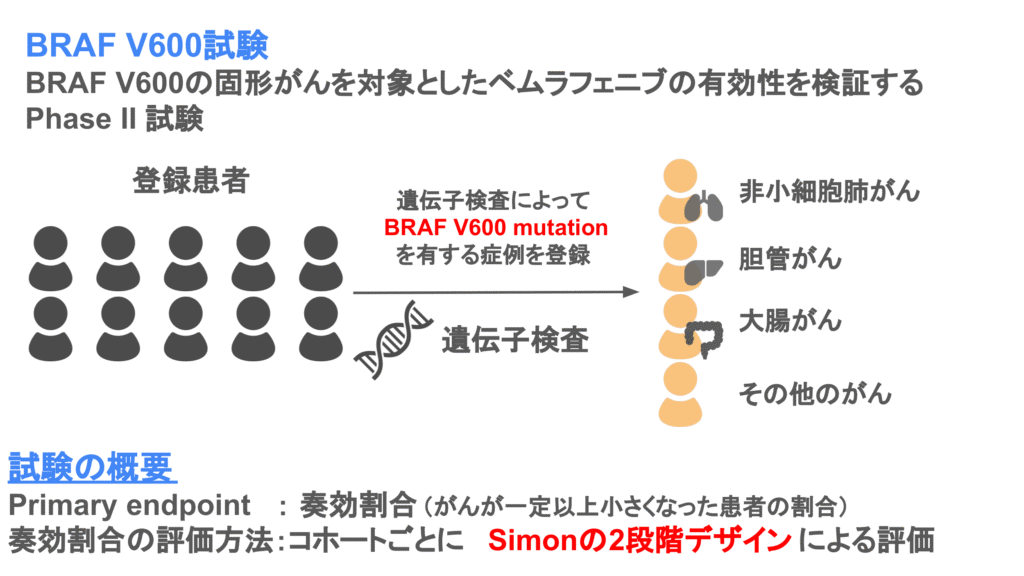
バスケット試験の例としてBRAF V600の固形がんを対象としたベムラフェニブの有効性を検証したPhase II試験があります。
https://www.nejm.org/doi/full/10.1056/NEJMoa1502309
この臨床試験では複数のがん患者さんにスクリーニング検査となる遺伝子検査を実施し、BRAF V600 mutationを有する固形がん患者さんを登録します。そして、登録したがん患者さんにベムラフェニブを投与し、ベムラフェニブの有効性を検証します。
有効性の評価は奏効割合によって行われ、Simonの2段階デザインによって有効性の確認を行います。Simonの2段階デザインによって有効性が確認できれば、Phase III試験に進んだり、承認申請をしたりすることが考えられます。
プラットフォーム試験
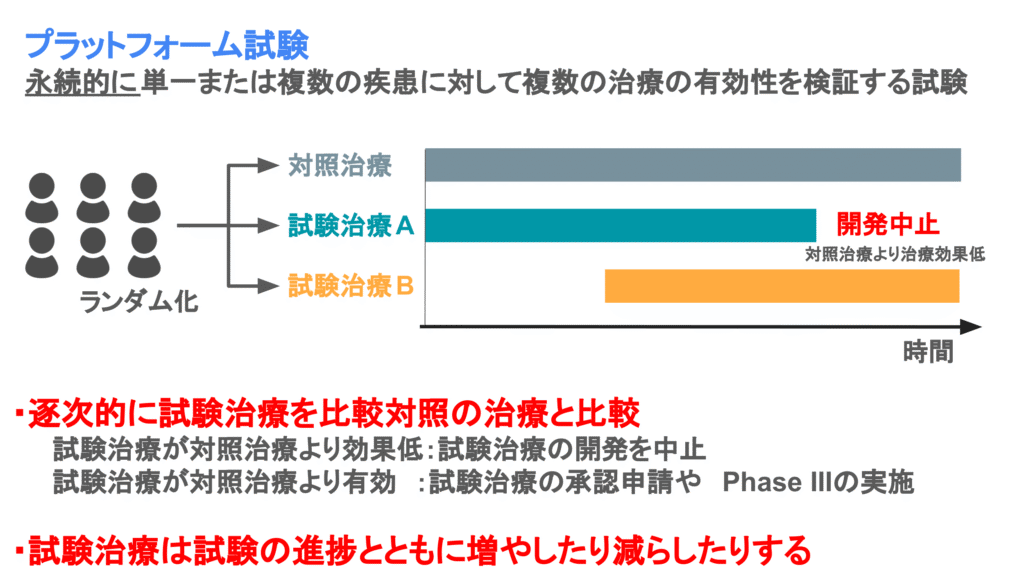
プラットフォーム試験は単一または複数の疾患に対して複数の治療の有効性を検証する試験デザインです。アンブレラ試験とバスケット試験を合わせた試験と考えられますが、大きな特徴は永続的な治療開発を目的としていることです。
永続的な治療開発を目的としていることから、試験治療が試験開始時点に決めたものだけでなく、途中で増えたり、比較対象となる標準治療が途中で変更されたりします。
プラットフォーム試験の例:I-SPY2試験
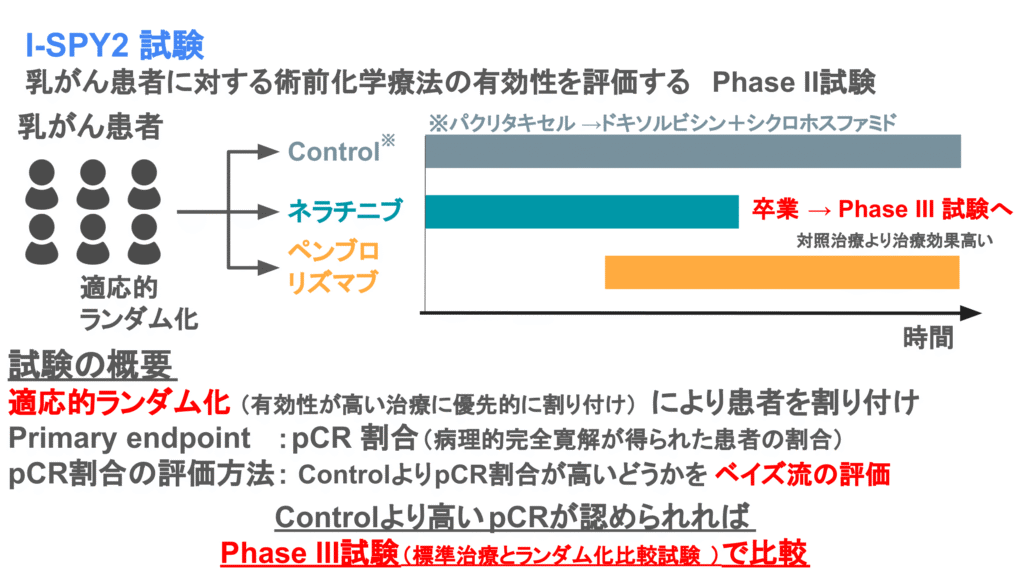
プラットフォーム試験の例としては、乳がんの永続的な治療開発を目的としたI-SPY2試験があります。
複数の試験治療と対照治療に患者をランダムに登録していき、順次試験治療の有効性をpCR割合によって評価します。ランダム化の方法は適応的ランダム化が用いられ、pCR割合が高い治療に優先的に患者が割り付けられるようになっています。
また有効性評価方法はベイズ流に行われます。試験治療の有効性が対照治療に対して一定以上確認できれば、Phase III試験に進み、標準治療とランダム化比較試験によって比較するという手順が取られています。
マスタープロトコルの試験の統計学的な注意点

統計家が書いているブログなので、せっかくなら統計学的な注意点もいくつか紹介!
試験デザインごとに注意点が異なるため、代表的な注意点のみに絞って解説します。
アンブレラ試験の有効性評価の注意点
アンブレラ試験は、サブ試験ごとに見れば単にランダム化比較試験を行っていることと変わりません。つまり、「アンブレラ試験の問題」ではなく、「ランダム化比較試験の問題」として見ることができます。
そのため、ランダム化比較試験で言われるようなランダム化の方法や試験対象の選択などに注意する必要があります。
バスケット試験の有効性評価の注意点
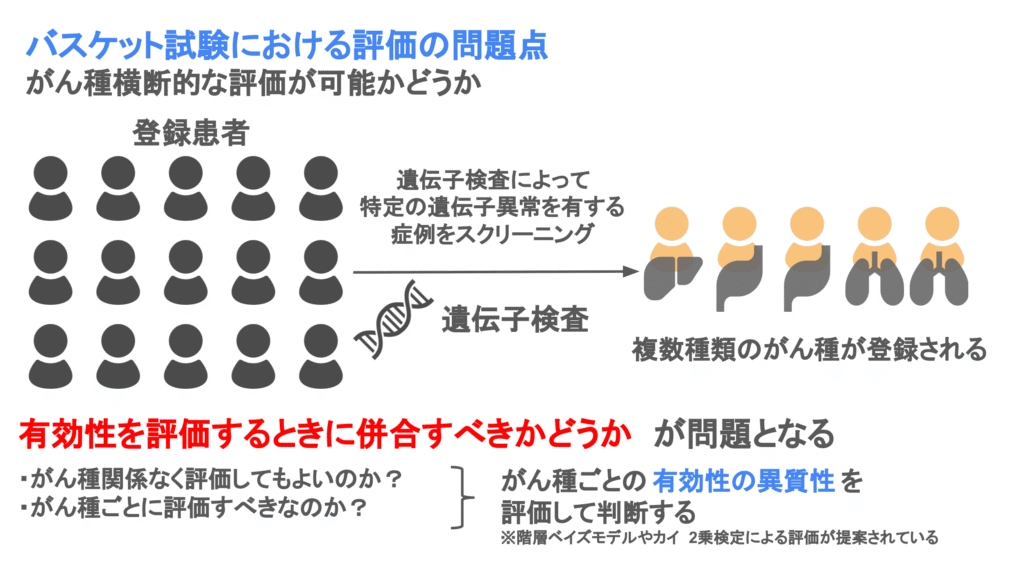
バスケット試験の統計学的な注意点としては、がん種横断的な評価が挙げられます。つまり、サブ試験を併合して評価してよいのか、サブ試験ごとに評価すべきなのか、を考える必要があります。
サブ試験を併合することによって、評価する症例数が増加し検出力が上昇する一方で、がん種間の有効性の異質性があるかどうかによって評価が変わってきます。例えば、一部のがん種のみ有効性がある状況で、併合した解析を行うと、有効性が認められず、有望な治療を見逃す可能性があります。
そのため、バスケット試験では有効性の異質性によって、サブ試験を併合するかどうかを判断することが提案されています。有効性が類似しているのであれば、サブ試験を併合した解析を行いますし、有効性が異なるのであれば、サブ試験ごとに解析することになります。
有効性の異質性を考慮した解析方法は複数提案されていますが、その中でも統計家の中で研究が進んでいる、階層ベイズモデルという方法を用いたベイズ流の解析です。
階層ベイズモデルを用いることで、有効性の異質性を考慮してサブ試験の併合を決めたり、併合せずともどの程度他のサブ試験の情報を使うか決めたりすることができます。
プラットフォーム試験の有効性評価の注意点
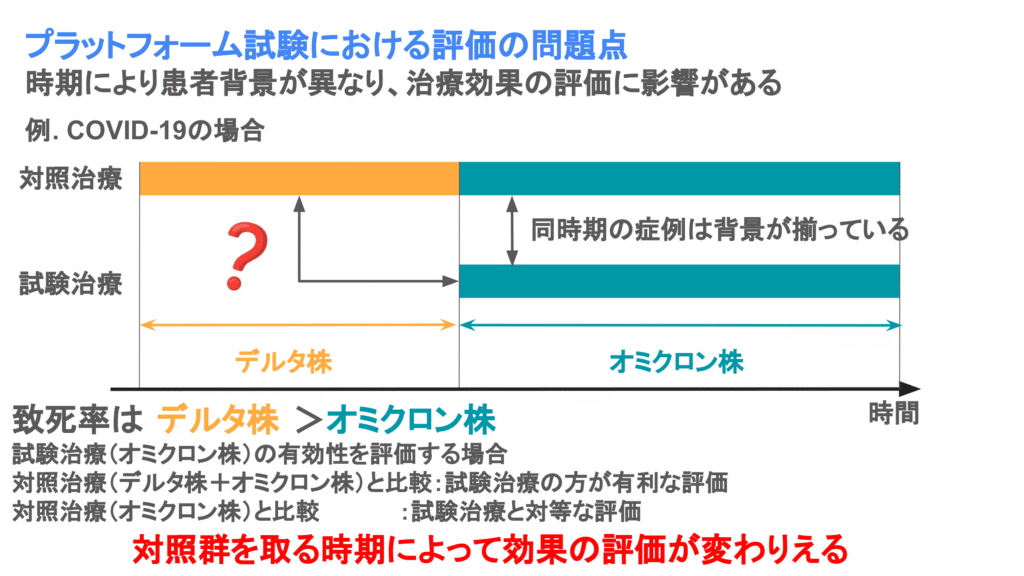
プラットフォーム試験は永続的な治療開発を目的としていることから、時期によって対照とする治療や患者の特性が異なることがあります。
例えば、抗がん剤領域に限らず、新たな治療法が開発されているような領域では、標準治療が変わっていくため、比較対照が常に変わりえます。
また感染症領域では登録される時期によって患者の特性が異なることが考えられます。例えば、COVID-19では、デルタ株やオミクロン株など、時期によって毒性の異なる変異株が発生していました。特にデルタ株はオミクロン株よりも致死率が高いことが知られているため、登録された患者にデルタ株が多いのか、オミクロン株が多いのかによって治療効果に差が出てきてしまいます。
そのため、時期によって患者背景が群間で異なり、評価に影響がある可能性があることには注意が必要です。
この問題の対策としては、同時期に登録された患者のみを対象として解析を行うことや、時期による患者背景を考慮した解析を用いることが挙げられます。
まとめ

今回はマスタープロトコル試験について解説しました!
まだ日本でも海外でも実施されているマスタープロトコル試験は多くありませんが、従来の治療開発方法では開発が困難な希少疾患では選択肢になり得るデザインです。そのため、ぜひマスタープロトコルの概要は覚えておきましょう!
最後にマスタープロトコルの参考文献を載せておきますので、さらに理解を深めたい方は以下も読んでみてください!
参考文献
- PMDA事務連絡:「医薬品開発等におけるマスタープロトコル試験の活用に関する留意事項」について(https://www.mhlw.go.jp/hourei/doc/tsuchi/T240621I0030.pdf)
- FDA Guidance: “Master Protocols for Drug and Biological Product Development”(https://www.fda.gov/regulatory-information/search-fda-guidance-documents/master-protocols-drug-and-biological-product-development)






コメント